CALORIMETRIA - CAPACIDADE TÉRMICA, CALOR ESPECÍFICO E CALOR SENSÍVEL
Calor é energia térmica em trânsito devida a diferença de temperatura entre os corpos. Ele flui espontaneamente do corpo de maior temperatura para o corpo de menor temperatura. Como outras formas de energia, sua unidade de medida é o Joule (J). Há também uma unidade de calor que é muito usada que é a caloria (cal).
Na imagem abaixo representamos um sistema fechado onde encontram-se dois objetos, A e B cujas temperaturas são TA > TB.

Enquanto houver diferença de temperatura entre os corpos, o corpo A perderá energia térmica enquanto o corpo B receberá energia térmica.
A transferência de energia é chamada de calor e por ser uma grandeza incontável (não dizemos um calor, dois calores,...) falamos em quantidade de calor representada pela letra Q.
Com a experiência de
Joule, na qual certo corpo A, caindo de uma altura h, faz girar uma hélice no
interior de um líquido e, com isso, aumenta a temperatura do líquido,
verifica-se a equivalência entre o trabalho mecânico e o calor.
O assim chamado
equivalente mecânico do calor é a relação 1 cal » 4,2 J.
Caloria é a quantidade
de energia necessária para elevar a temperatura de um grama de água de 14,5 °C
para 15,5 °C.
Capacidade
térmica:
Define-se capacidade térmica de um
sistema como a energia necessária para alterar a temperatura de um corpo em uma
unidade.
Exemplo:
Ao fornecer 300 calorias de calor para um corpo, verifica-se
como consequência uma variação de temperatura igual a 50 ºC. Determine a
capacidade térmica desse corpo em cal/ºC e em J/K.
Exemplo resolvido em vídeo em breve
Calor
específico:
O
calor específico pode ser entendido como sendo a medida numérica da quantidade
de calor que acarreta uma variação unitária de temperatura na unidade de massa
da substância. Pode também ser calculado pela razão entre a capacidade térmica
e a massa da substancia.
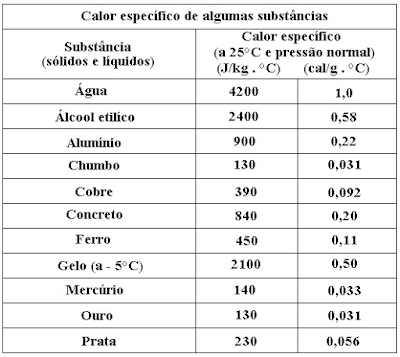
A tabela abaixo mostra o valor do calor específico de diversas substâncias:
Exemplo:
(UF Paraná)
Para aquecer 500 g de certa substância de 20 ºC para 70 ºC, foram necessárias 4 000 calorias. A capacidade térmica e o calor específico valem respectivamente:
a) 8 cal/ ºC e 0,08 cal/g .ºCb) 80 cal/ ºC e 0,16 cal/g. ºC
c) 90 cal/ ºC e 0,09 cal/g. ºC
d) 95 cal/ ºC e 0,15 cal/g. ºC
e) 120 cal/ ºC e 0,12 cal/g. ºC
Resolução em vídeo:
QUANTIDADE DE CALOR SENSÍVEL
É a quantidade de
ENERGIA que uma substância recebe ou libera para alterar sua temperatura, sem mudança
de seu estado físico.
Exemplo 1:
(Física Resolvida - 2005) Suponha que em um verão escaldante você chegue em casa e resolva abrir a geladeira e retirar uma forma de gelo que sua mãe colocou há pouco tempo. Nesta forma você encontra gelo se formando (apenas uma fina camada de gelo sobre cada cavidade da forma). Você, como já deve ter feito várias vezes fura a camada e despeja a água muito gelada sobre um copo de 250 mL (cerca de 250 g) preenchendo-o completamente. É bem razoável pensar que esta água do copo esteja a uma temperatura de 0°C, pois a água já estava congelando.
Você bebe estes 250mL de água que por sua vez irão roubar energia de seu organismo esquentando até a temperatura de seu corpo (cerca de 36°C).
Considerando o calor específico da água como sendo de 1cal/g.°C, qual é a quantidade de calorias perdidas para a água?
Resolução em vídeo:
Exemplo 2:
MACKENZIE
a) 0,8 cal/g . °C
b) 0,7 cal/g . °C
c) 0,6 cal/g . °C
d) 0,4 cal/g . °C
e) 0,2 cal/g . °C
Resolução em vídeo:
Exemplo 3:
UFRGS - 1996
Um cubo de gelo com massa de 2 kg, já na temperatura de fusão da água, está inicialmente em repouso a 10 m acima de uma superfície rígida. Ele cai livremente e se choca com esta superfície. Qual é, aproximadamente, a máxima massa de gelo que pode se fundir nesse processo? Dados: Calor de fusão do gelo = 80cal/g; 1 cal = 4,18J; aceleração gravitacional = 10m/s2.
a) 0,2 g
b) 0,6 g
c) 1,0 g
d) 1,2 g
e) 1,5 g
Resolução em vídeo:
Exemplo 4:
FUVEST
Adote: calor específico da água: 1,0 cal/g°C
Calor de combustão é a quantidade de calor liberada na queima de uma unidade de massa do combustível. O calor de combustão do gás de cozinha é 6000 kcal/kg. Aproximadamente quantos litros de água à temperatura de 20 °C podem ser aquecidos até a temperatura de 100 °C com um bujão de gás de 13 kg?
Despreze perdas de calor:
a) 1 litro b) 10 litros
c) 100 litros
d) 1000 litros
e) 6000 litros
Resolução em vídeo:
CLIQUE AQUI E CONHEÇA O FÍSICA RESOLVIDA - GRUPOS DE ESTUDOS PARA ENEM & VESTIBULAR
CLIQUE AQUI E ACESSE O CAPÍTULO DO LIVRO DO FÍSICA RESOLVIDA SOBRE CALORIMETRIA












Comentários
Postar um comentário